为指导申办者/主要研究者提交涉及人的生命科学和医学研究项目伦理审查申请/报告,大连医科大学附属第二医院伦理委员会(以下简称“伦理委员会”)特制定本指南。
一、伦理审查的依据和范围
伦理委员会根据国家局发布的《药物临床试验质量管理规范》(2020年)、《医疗器械临床试验质量管理规范》(2022年)、《药物临床试验伦理审查工作指导原则》(2010年)、《涉及人的生物医学研究伦理审查办法》(2016年)、《涉及人的生命科学和医学研究伦理审查办法》(2023年)等,以及国际《赫尔辛基宣言》(2013)等法规指南的要求开展工作。
下列范围的涉及人的研究项目应依据本指南提交伦理审查申请/报告:
药物临床试验
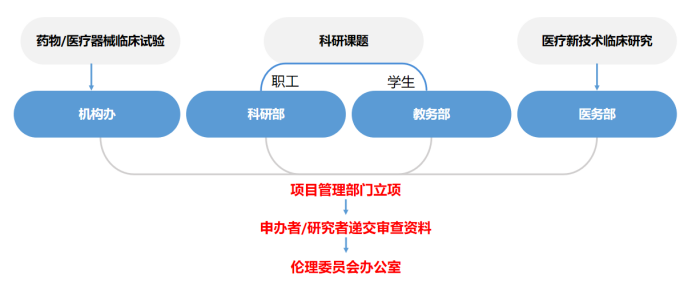
医疗器械临床试验
纵向/横向/由研究者自行发起的科研课题
学生课题
院内医疗新技术临床研究
二、伦理审查前流程
送审人员应先将送审材料递交到对应的项目管理部门立项:药物临床试验机构办公室、学科建设与科研管理部、教务部或医务部进行立项审查,审查通过后,将主要研究者与主管部门签字的《药物/医疗器械临床试验伦理审查推荐表》、《科研课题伦理审查推荐表》、《学生课题伦理审查推荐表》、《医疗新技术伦理审查推荐表》(以下简称《伦理审查推荐表》)递交到伦理委员会办公室(以下简称“伦理办公室”),方可进行接下来的伦理审查申请。
三、伦理审查申请/报告类别
1. 初始审查申请
研究者应当在研究开始前提交伦理审查,经伦理委员会审查同意后方可实施。
若研究符合以下情形,可按照流程与要求进行伦理审查申请:
1.1变更或豁免知情同意
变更知情同意是指仍然会获得知情同意,但披露的要素或知情同意的文件证明与法规要求有所不同,包括:
Ø变更提供给受试者的信息,例如隐瞒信息。
Ø变更知情同意的文件证明,例如免除知情同意的签字。
豁免知情同意是指豁免同意的整个要求,包括同意过程的属性和披露要素,这意味着允许研究者在没有获得完全知情同意的情况下进行研究。
变更或豁免知情同意应当同时满足以下三个前提条件:
Ø如果没有变更或豁免,研究将不可行或无法实施。
Ø研究具有重要的社会价值。
Ø研究对受试者造成的风险不超过最低风险。
变更或豁免知情同意需要正当的理由并得到伦理委员会的审查同意。
1.2免除伦理审查
使用人的信息数据或者生物样本开展以下情形的涉及人的生命科学和医学研究,不对人体造成伤
害、不涉及敏感个人信息或者商业利益的,可以免除伦理审查:
Ø利用合法获得的公开数据,或者通过观察且不干扰公共行为产生的数据进行研究的;
Ø使用匿名化的信息数据开展研究的;
Ø使用已有的人的生物样本开展研究,所使用的生物样本来源符合相关法规和伦理原则,研究相关 内容和目的在规范的知情同意范围内,且不涉及使用人的生殖细胞、胚胎和生殖性克隆、嵌合、可遗传的基因操作等活动的;
Ø使用生物样本库来源的人源细胞株或者细胞系等开展研究,研究相关内容和目的在提供方授权范围内,且不涉及人胚胎和生殖性克隆、嵌合、可遗传的基因操作等活动的。
2. 复审申请
按伦理审查意见“必要的修改后同意/作必要修改后同意/修改后批准”、“修改后再审”,研究者应当在获得审查书面意见后分别2、3个月内,对方案进行修改后,应当提交复审,经伦理委员会审查同意后方可实施。
如果对伦理审查意见有不同看法,可以通过复审申请的方式提出不同意见,请伦理委员会重新考虑决定。
3. 跟踪审查申请
3.1 修正案申请
研究过程中若变更主要研究者,或对研究方案、知情同意书、招募受试者材料、以及提供给受试者的其他书面资料(如受试者日记卡、联系卡、评分表、须知等),研究者手册的修改,研究者应当获得伦理委员会同意后执行。
为避免研究对受试者的紧急危险,主要研究者可在伦理委员会同意前修改研究方案,事后应当及时将修改研究方案的情况及原因,以“修正案审查申请”的方式提交伦理委员会审查。
3.2 年度/定期研究报告
研究者应当向伦理委员会提交临床研究的年度进展报告,或者按照伦理审查意见所要求的年度/定期审查频率提交研究进展报告,但至少每年报告1次。
如果伦理审查同意研究的有效期到期,可以在到期前至少1个月通过年度/定期研究进展报告申请延长有效期。
3.3 安全性报告
3.3.1 注册类药物临床试验
①报告范围:需向伦理委员会报告严重不良事件(仅涉及本院死亡,包括其他所需要的资料,如尸检报告和最终医学报告)、所有可疑且非预期严重不良反应(以下简称“非预期严重不良反应”;对于外院报告可以汇总报告的形式,如总体安全性评估和行列表,应定期月度报告)、研发期间安全性更新报告/执行摘要,可能对受试者的安全或者临床试验的实施产生不利影响的新信息。
②报告时限:
Ⅰ.本院发生的死亡严重不良事件
研究者应在获知并签收后24小时内,尽快逐例次报告伦理委员会,并尽快提交其他所需要的资料,如尸检报告和最终医学报告。
Ⅱ.本院发生的非预期严重不良反应
对申办者报告时限要求:
对于致死或危及生命的非预期严重不良反应,申请人应在首次获知后尽快逐例次报告,但不得超过 7 天,并在随后的 8 天内报告、完善随访信息。(注:申请人首次获知当天为第 0 天)。
对于非致死或危及生命的非预期严重不良反应,申请人应在首次获知后尽快逐例次报告,但不得超过 15 天。所有报告将发送电子版至伦理委员会指定收集申办方直报安全性信息的邮箱dy2y_safety@126.com并自行保存发送记录,本中心不提供回执。
对研究者报告时限要求:
研究者应当向伦理委员会快速逐例次报告由申办方提供的非预期严重不良反应。
致死或危及生命的应在首次获知后7 天内报告,并在随后的 8 天内报告、完善随访信息。(注:申办者首次获知当天为第 0 天)。
非致死或危及生命的应在首次获知后15 天内报告。
递交纸质版资料时会对电子版资料和纸质版资料进行形式审查。电子版和纸质版形式审查均通过后(缺一不可),视为递交成功。
Ⅲ.外院发生的非预期严重不良反应
研究者应当向伦理委员会提交申办者提供的外院发生的非预期严重不良反应,外院报告可以汇总报告的形式(如总体安全性评估和行列表),定期按月度报告,一般不超 3 个月。
Ⅳ. 研发期间安全性更新报告/执行摘要
申办者需将报告/执行摘要(附严重不良反应累计汇总表)有关信息报告伦理委员会,应当每年至少提交1次。
3.3.2 注册类医疗器械临床试验
①报告范围:需向伦理委员会报告严重不良事件,可能对受试者的安全或者临床试验的实施产生不利影响的新信息。
②报告时限:
Ⅰ.本院发生的严重不良事件
研究者应当立即对受试者采取适当的治疗措施;同时,研究者应当在获知并签收严重不良事件后24 小时内逐例次向伦理委员会报告;并按照临床试验方案的规定随访严重不良事件,提交严重不良事件随访报告。
Ⅱ.外院发生的严重不良事件
申办者应及时按月份汇总并提交我院伦理委员会审查;并同时递交上述外院报告的汇总报告,如总体安全性评估和行列表;汇总间隔原则上不超 3 个月。
3.3.3非注册类由研究者发起的临床研究(包括纵向/横向/由研究者自行发起的科研课题、学生课题、院内医疗新技术临床研究)
①报告范围:需向伦理委员会报告本中心发生的严重不良事件和其他安全性信息。
②报告时限:本院发生的严重不良事件,研究者应当在获知并签收严重不良事件后24小时内逐例次向伦理委员会报告;并按照临床试验方案的规定随访严重不良事件,提交严重不良事件随访报告。
3.4 偏离方案报告
增加受试者风险或者显著影响临床研究实施的偏离方案,研究者应当及时逐例次向伦理委员会报告,一般在获知后不超过1个月。
其他的偏离方案可以定期汇总在年度/定期研究进展报告中向伦理委员会报告。
3.5 终止/暂停研究报告
研究者/申办者提前终止/暂停临床研究,应及时向伦理委员会报告。
3.6 研究完成报告
(本中心)研究完成后,研究者应当向伦理委员会提交研究完成报告,以证明研究的完成。
四、提交伦理审查申请/报告流程
1.送审
1.1获取途径
大连医科大学附属第二医院官网-院务公开-伦理资料下载中的伦理审查申请须知/报告指南。
1.2说明
伦理审查申请须知/报告指南下载区根据送审类别分为各个文件夹:初始审查、复审、修正案审查、年度/定期跟踪审查、安全性审查、偏离方案审查、终止/暂停研究审查、研究完成审查。送审文件清单与申请表等模板包含在各个文件夹中。
1.3送审要求
1.3.1文件清单
根据送审文件清单(见附件),准备送审文件。
1.3.2文件要求
①递交1份签字盖章(首页章与骑缝章)的纸质版文件。【此项适用于注册类临床试验项目】
②送审材料若为多页请双面打印,并制成打孔文件或活页夹文件便于替换。
③材料需要有递交信、封面、目录以及带有序号的隔页纸(序号与目录序号一致,且隔页纸在每一号文件的前面)。
1.3.3递交时限
通过伦理委员会办公室(以下简称“伦理办公室”)形式审查后,向伦理办公室提交1份签字盖章(首页章与骑缝章)的纸质版文件和1份电子版文件(扫描件或PDF文件),纸质版须与电子版内容完全一致,且电子版文件命名应注明文件名称、版本号以及版本日期,文件命名与纸质版文件一致。
通过形式审查的会议审查资料,提交截止日期为会议前10天。否则,将顺延至下次会议。
2.审查方式
根据送审项目类别与项目文件内容决定审查方式。
2.1 会议审查
2.1.1 会议时间
伦理委员会例行审查会议一般每月安排2次,具体日期联系伦理委员会确认为准。需要时可以增加临时的审查会议。
研究过程中出现危及受试者生命安全的重大非预期问题,伦理委员会将召开紧急会议审查。
2.1.2 主要研究者报告与答疑
①主要研究者应到会报告和答疑,需要准备8分钟以内的会议报告,会议报告PPT模板可在大连医科大学附属第二医院官网中下载。汇报PPT要求在会议前3天与伦理办公室联系提交。
②主要研究者因故不能到会,应当事先向伦理委员会办公室请假,并授权助理研究者或研究人员(职称为副高或副高以上),到会报告和答疑。授权研究人员需向伦理委员会提交委托书,说明主要研究者不能到会原因,并代替汇报该项目的被委托人姓名以及被委托人是否有能力报告和答疑,且委托人与被委托人签字确认。
2.2快速审查
请参照伦理审查申请须知/报告指南按需提交1套完整的送审文件。
五、审查决定的传达
伦理委员会将以“伦理审查同意函/意见函”的书面形式传达审查决定。
会议审查在伦理审查决定做出后5个工作日内完成传达;快速审查在正式受理后10个工作日内完成传达决定。
六、伦理审查的费用
1.费用
注册类药物/医疗器械临床试验:初始审查/修正案审查:5000元/项(含税)。
其他类审查暂不收费。
2.账号
伦理审查费缴纳至医院财务处统一管理,
名称:大连医科大学附属第二医院
开户银行:光大银行西岗支行
汇款帐号:75910188000055140
注:转账时请备注:项目编号+初审/修正案-版本号+试验药/器械简称+病种
3.说明
申办者需在项目受理后缴费,并在例行审查会议前10天提交缴费回执,否则将顺延至下场伦理会。
七、伦理办公室联系方式
1.接待时间
每周一、二、三、五,下午1:30-4:30,请提前预约,详询伦理办公室。
2.办公室电话
0411-84671291-7608
3.地址
大连医科大学附属第二医院行政中心6楼-6F008室
4.联系人
林喆,韩璐璐,谭惠心
5.邮箱
dy2ylunli@126.com
6.伦理办公室接受我院研究者的伦理审查咨询和受试者抱怨/沟通。
八、文件下载
注册类项目伦理申请(药物及器械临床试验)
非注册类项目伦理申请(包括横向/纵向/由研究者发起的临床研究、学生毕业课题)



